【印刷可能】 銅 酸化 化学式 608014-銅 酸化 化学式
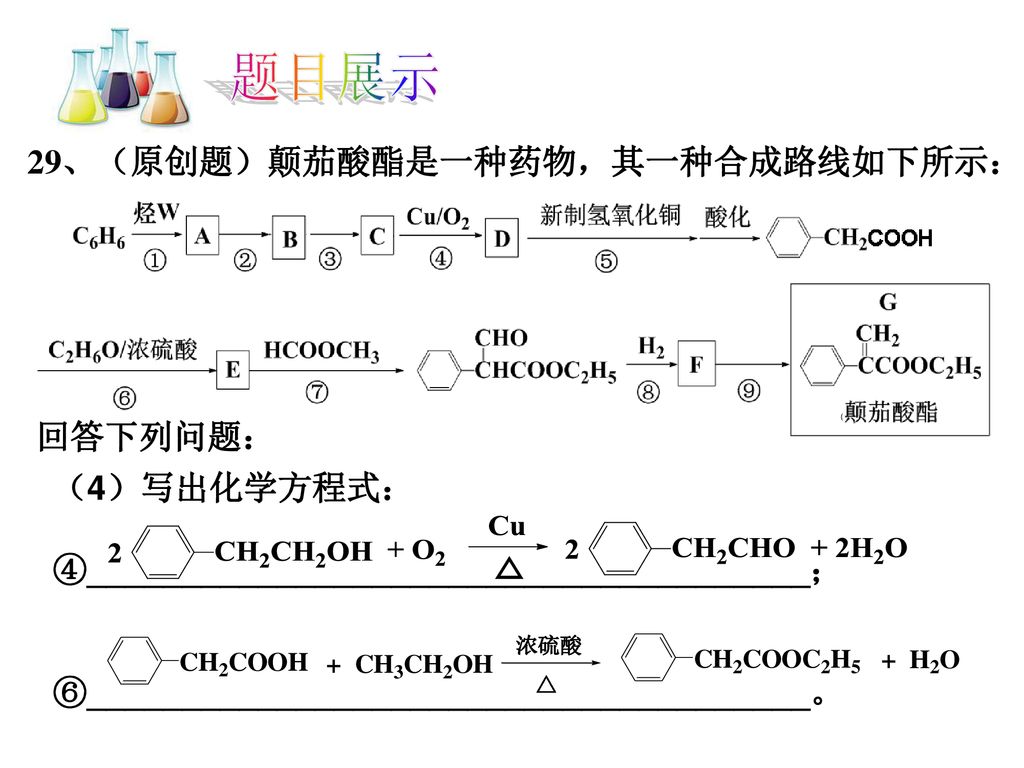
なんこつ 銅に濃硫酸を加えて加熱するという化学反応式を書く問題で、上の式で良いかと思ったけど、下の式が正しいようです。 どうして上の式じゃいけないんですか? X C李0 一 ksox 5 9 6 2Fr90x 時 Cs9y 1 ED 明玉8 銅の酸化 (燃焼)の化学反応式 2Cu O2 → 2CuO だね! この銅Cuが酸化される化学反応は,銅Cuと酸素Oのそれぞれに注目して次の2つの反応の合成と考えることができます. ここで,$\ce{e}$は電子で,このように電子$\ce{e}$を含んだ反応式を 半反応式 といいます.

File Redox Cuo Chemical Formula Jp Svg Wikimedia Commons
銅 酸化 化学式
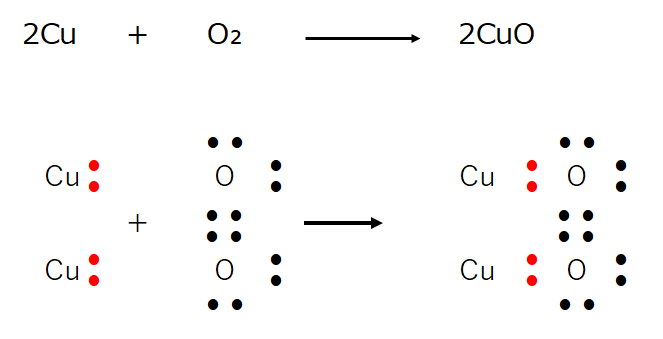
銅 酸化 化学式- 化学反応式 水の電気分解 2H 2 O→2H 2 O 2 塩化銅の分解 CuCl 2 →CuCl 2 水素と酸素の化合 2H 2 O 2 →2H 2 O 鉄と硫黄の化合 FeS→FeS マグネシウムの燃焼 2MgO 2 →2MgO 塩酸と水酸化ナトリウムの中和 HClNaOH→NaClH 2 O マグネシウムと塩酸の反応 Mg2HCl→MgCl 2 H2 銅を空気中の酸素と完全に反応させると,赤かっ色の銅が,黒色に変化しました . では,この黒色の物質は何なのか? また,どのような性質があるのか確認して行きましょう. 確認実験をまとめ 結論,銅を加熱してできた黒い物質は,酸化銅という物質になります. 銅の酸化: 銅 + 酸素 → 酸化銅 化学反応式: 2Cu + O2 → 2CuO 銅の酸化に関するよく出る問題 問題 銅を加熱した




Cna 化学镀镍浴 Google Patents
2MgO₂→2MgO ※酸化銅・酸化マグネシウムの化学反応式は金属の化学式が異なるだけです。 ・マグネシウム( Mg )いろいろな物質と反応しやすい金属で、酸化する際、熱と光を伴ないます。 以前は写真屋さんで記念撮影するときのカメラのフラッシュに使われていたのですが、今はもう使ってないかな? ・酸化マグネシウム( MgO )酸素とマグネシウムが化合してできた物質。 上記の酸酸化銅の数を増やさなければならない。 もう一度原子の数をみると今度は銅が1足りないので、左辺の銅を増やす 原子の数 Cu O 2 2 2 2 これで両辺の原子の数が等しくなったので、モデルを化学式になおす。 2CuO 2 →2CuO 化学反応式をつくるときの注意点銅は1(第一銅)および2(第二銅)の 酸化数 を取り、豊富な種類の 化合物 を形成する 。 銅は水とは反応しないものの、空気中の 酸素 とは徐々に反応して黒褐色をした 酸化銅 の被膜を形成する。 生じた 錆 によって全体が 酸化 されてしまう 鉄 とは対照的に、銅の表面に形成される 酸化被膜はさらなる酸化の進行を防止 する。 湿った条件下では 二酸化炭素 の作用により 緑青 ( 水酸化炭酸銅 )
1 粉末銅0.5gを50mLのビーカーに入れ,6mol/L硫酸H 2 SO 4 10mLと10%過酸化水素水H 2 O 2 5mLを加え,穏やかに加熱する。 粉末銅が残っていれば,さらに少量の過酸化水素水を加える。金属の酸化物の化学式 酸素原子 O (手の数 2 本)と金属の原子を手の数が同じになるようにくっつける 。このとき,「金属原子,その数,酸素原子,その数」の順で書く。主な金属の酸化物の化学式は書けるようにしよう。 例題 (1) 銀 Ag の酸化 (2) 銅 Cu の 酸化還元反応=電子eの授受をともなう反応です。 このとき,銅と濃硝酸はそれぞれ次のような変化をします。 ①銅: Cu → Cu2+2e (還元剤として働く) ②濃硝酸: HNO3+H+e → NO2+H2O (酸化剤として働く) 電子の係数を合わせて消去するために,①+2×②をつくると, Cu+2HNO3+2H → Cu2+2NO2+2H2O となります。 ここで,『化学反応式では単体または化
酸化銅 (Ⅰ)は Cu2O 酸化銅 (Ⅱ)は CuO という化学式です。 ()内にある数は、「銅の酸化数」言い換えれば、銅がいくつ+になっているかを表しています。 酸化銅 (Ⅰ)は銅がCuとなっています。 酸素はO2としてつながると考えてください。 だから、2の酸素に対して1の銅は2つ必要になるので Cu2O となるわけです。 一方、酸化銅 (Ⅱ)は銅がCu2となっています。 2の酸素に対し化学反応式 化学変化3 酸化銀を熱分解すると,銀と酸素ができる。 化学反応式 化学変化4 鉄と硫黄の混合物を加熱すると,硫化鉄がで きる。 化学反応式 化学変化5 酸化銅と炭を混ぜて加熱すると,二酸化炭素 が発生し,金属の銅ができる。 化学反応式 中学生が学習する化学式についてまとめました.絶対に覚えたい化学式の他に,難関高校で問われる難しい化学式も載せました.また,化学反応式を作る準備のために,2H,H2,2H2の違いについても解説しています. 中2化学 銅の酸化 計算問題 銅の酸化




銅の酸化 燃焼 の実験を中学生向けに解説




Ppt 第三课时铁及铜的化合物powerpoint Presentation Free Download Id
物質名 化学式 物質名 化学式 水素 ② H 2 水 ⑤ H 2O ① 酸素 O 2 ④二酸化炭素 CO 2 銅 ③ Cu 塩化ナトリウム ⑥ NaCl ⑵ 次の化学式の中から化合物をすべて選べ。 Fe CuO Ag 2 O Cl 2 NH 3 N 2 Mg NaHCO 3 3 水の電気分解を化学反応式で表したものである。酸化銅(II)(さんかどう に、英 copper(II) oxide )は化学式 CuO で表される銅の酸化物で、黒色の粉末。 CAS登録番号は。 水、アルコールに不溶。 塩酸、硫酸、塩化アンモニウム溶液、アンモニア水などに可溶。 融点1,026 °C 。 1,050 °C 以上で分解して酸化銅(I)になる。《化学反応式 ②》 <化学反応式の書き方> ① 「反応する物質 → 反応してできる物質」の形式で,何と何から何ができるかを書く。 ② ①で書いたそれぞれの物質を化学式で表す。 ③ 化学変化の前後(式の左辺と右辺)で,各原子の種類と数が等しくなる



Cms Nahaken Okn Ed Jp
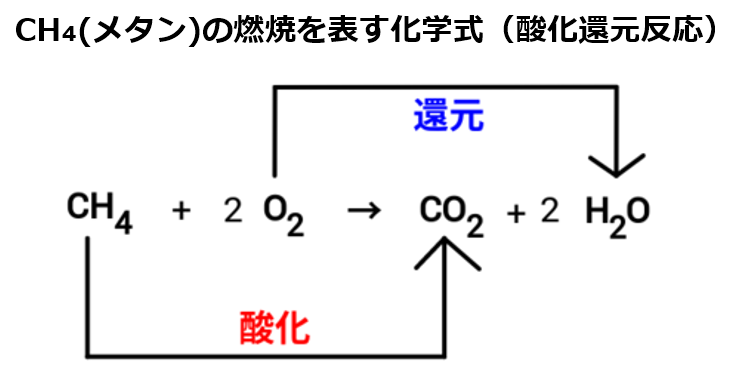



酸化還元反応 電子のやり取り
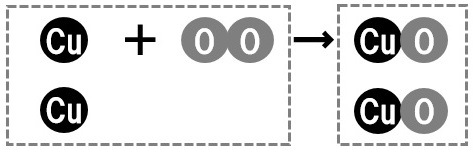
イオン化傾向とは金属元素の陽イオンへのなりやすさを表していて原子によって決まっています。 イオン化列はイオン化傾向の大きい順に並べたものです。 イオンになるということは酸化還元反応が起こるのですが、 イオンになる傾向と反 酸化銅と炭素の混合物を熱する 2CuO C → 2Cu CO 2 酸化銅の酸素が炭素と反応して二酸化炭素になることで、銅が還元される。 酸化鉄に水素を送りながら熱する Fe 3 O 4 4H 2 → 3Fe 4H 2 O 酸化鉄の酸素が水素と反応して水になることで、鉄が還元される。(1)は、銅と酸素から酸化銅ができる化学反応式をつくる問題です。 銅酸素→酸化銅 という式がすでに書かれていますね。 まず、銅と酸素と酸化銅をモデルにして描いてみます。 銅はCuで、酸素はOです。また酸化銅はCuOです。 すると、次のような式ができ



化学式の質問です理科のテキストで酸化銅の化学式が2cu O2 2cuoと解 Yahoo 知恵袋




Ppt 第三课时铁及铜的化合物powerpoint Presentation Free Download Id
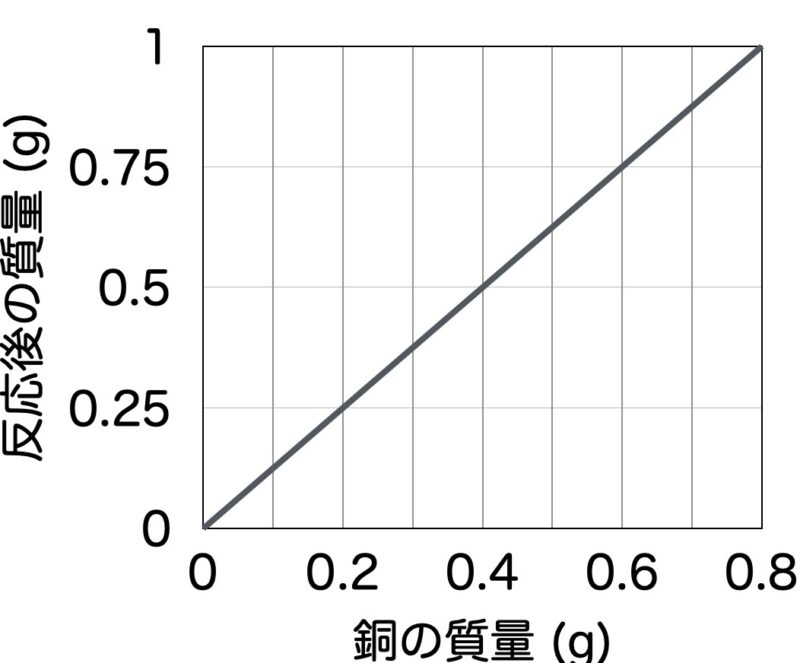
化学反応式が苦手な人は、下のボタンから学習してみてね! 化学反応式の学習を一から始めるにはここから 4銅と酸素の質量比 最後に銅と酸素が化合する質量比について簡単に説明するよ。 銅と酸素の質量比は 銅:酸素=4:1 なんだ。 つまり、4gの銅があると、1gの酸素がくっついて、5gの酸化銅ができるんだね! 同じように 酸化銅の化学式 は CuO だね。 モデル (絵)で書くと だね。 炭素の化学式 は C だね。 モデル (絵)で書くと だね。 次に、 銅の化学式 は Cu だね。 モデル (絵)で書くと だね。 最後に、 二酸化炭素の化学式 は CO2 だね。 モデル (絵)で書くと だね。 まずはこの化学式をしっかりと覚えてね! 化学式を正確に覚えないと、化学反応式は書けないんだよね! そうそう。 特に、 「酸化銅」は酸化還元 酸化銅の粉末に水素を混ぜながら加熱した。 このときの化学反応式を書きなさい。 この実験のように酸化物から酸素を取り除く反応を何というか。




初三化学 化肥知识点总结 肥料




中考化学第四单元自然界的水第2课时化学式与化合价课件76下载 Ppt模板 爱问共享资料
したがって、酸化銅と炭素を反応させると、二酸化炭素と銅ができます。 これを日本語の式で表してみると、 酸化銅炭素→二酸化炭素銅 となりますね。 さらに、化学式で表してみましょう。 酸化銅は銅に酸素がくっついたCuOという式で表されます。この時の化学反応式は 「Cu (OH)2 → CuO H2O」 となります。 加熱をすることで化合物が分解していく反応は、覚えにくいのでしっかりと覚えましょう。 また、酸化銅(Ⅰ)と同じように、水には溶けませんが、塩酸、硫酸、アンモニア水などに溶けます。 この時の硫酸に溶ける反応式を確認します。 「CuO H2SO4 → CuSO4 H2O」 となります。 これは、係数を付ける必要がないので簡単な酸化銅と水素を反応させると、酸化銅が還元され酸素が外れ銅ができます。 この反応を文字で表すと「酸化銅 + 水素 → 銅 + 水」になり、「CuO H2 → Cu H2O」 ③化合 2つ以上の物質がくっつき新しい生成物ができること。 酸化も広い意味でとらえれば化合と呼べます。 鉄と硫黄を反応させると硫化鉄になりますが「 鉄 + 硫黄 → 硫化鉄」を化学反応式で表すと「Fe S → FeS」です。 これは




中2理科 銅 酸素の化学反応式 練習編1 映像授業のtry It トライイット




中2化学 銅の酸化 計算問題 Hiromaru Note
美樹 「いまの実験の化学反応式はCuO+H 2 →Cu+H 2 O。 酸化銅(Ⅱ)・CuOは、水素・H 2 と反応して、銅・Cuと、水・H 2 Oになった。 このとき、 酸化銅(Ⅱ)・CuOは、酸素・Oを失っている。 このように、 物質が酸素・Oを失ったとき、その物質は『還元された』といい、その反応を 『還元』 という んだ。 」 福 「 『還元』 か。化学反応式と式量 銅の酸化を式量で考えてみよう。 O = 16 , Cu = 64 反応式と式量を使うと,ある量の Cu から CuO が何 g できるか求めることができる。式量は相対的な質量なので,物質どうしの重さを比べることができる。化学反応式は CuO C2H5OH(エタノール) → Cu CH3CHO(アセトアルデヒド) H2O という反応をしますが、生徒にはエタノール中の水素が酸化銅を還元して銅になる。 という説明でよいと思いま す。 このほか、ナフタレンなどの芳香族のものでもできます。 中学校では還元イコール酸素を物質からとる反応で必ず酸化とペアになっている。 とここまでですが、高校になる と、電子のやり
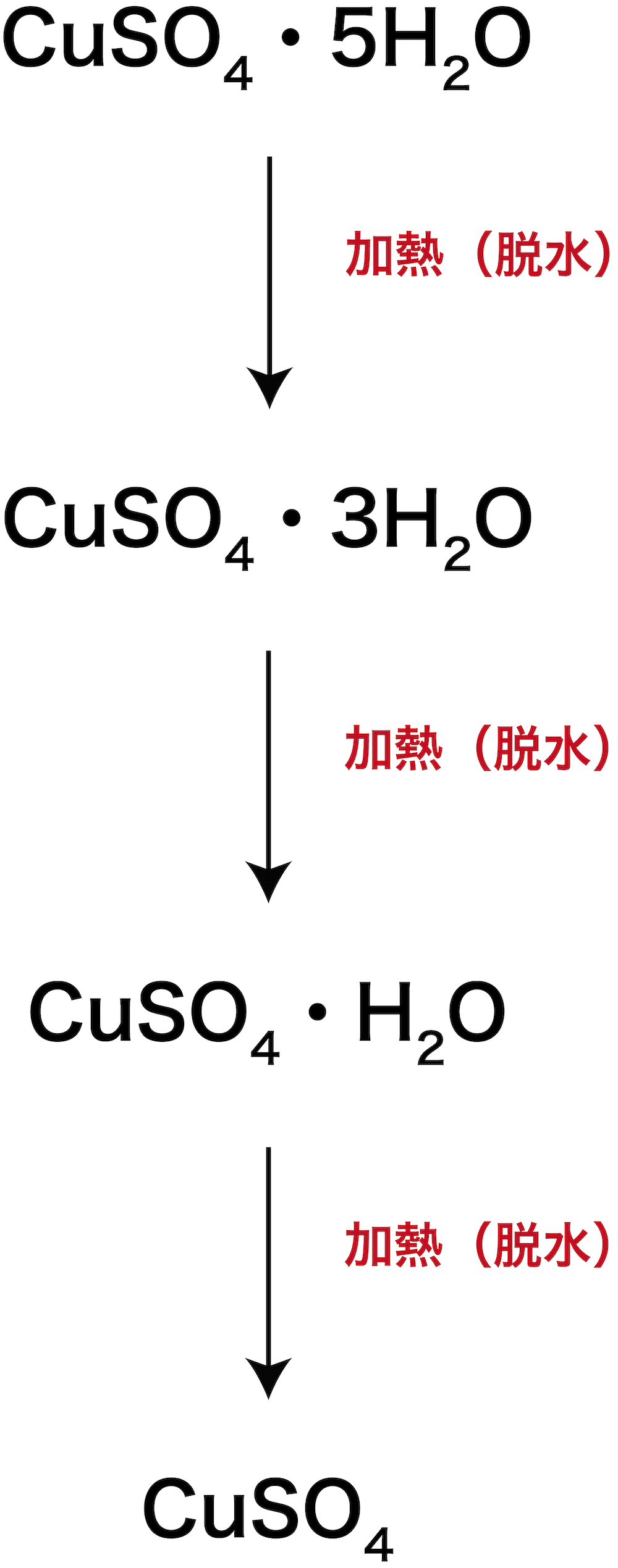



硫酸銅五水和物 化学式 構造式 頻出問題の解法など 化学のグルメ




18年中考化學考點總結 超詳細 喜歡的朋友記得收藏或轉發 每日頭條
まずは、酸化と還元について復習してみましょう。 酸化銅(Ⅱ)と水素の化学反応式は CuO + H 2 → Cu + H 2 O と表せます。 銅と熱濃硫酸 Cu 2H 2 SO 4 → CuSO 4 SO 2 2H 2 O 銅と希硝酸 3Cu 8HNO 3 → 3Cu (NO 3) 2 2NO 4H 2 O 銅と濃硫酸 Cu 4HNO 3 → Cu (NO 3) 2 2NO 2 2H 2 O これらの反応はすべて酸化還元反応であり、この3つの化学反応式は酸化還元反応の化学反応式の作り方で化学名又は一般名 酸化銅(Ⅱ) 別名 酸化第二銅 濃度又は濃度範囲 100% 分子式 (分子量) cuo 化学特性 (示性式又は構造式) cas番号 官報公示整理番号 (化審法) 1297 官報公示整理番号 (安衛法) データなし 分類に寄与する不純物及び安定化添加物




人教版九年級化學下冊各單元知識點總結 需要的朋友收藏了



Iy48lbyx8fd6fm
例水(h₂o)、二酸化炭素(co₂)、酸化銅(cuo)など 化学式とは ここまでで説明したように、物質にはいくつかの存在形式がありますが、ここでは原子の記号を使って、物質が書き表されていました。 この表記を「化学式」と言います。 Substance name 水酸化銅 (II) Copper (II) hydroxide 化学式 Chemical formula Cu (OH) 2 外観 Appearance 青色の固体1/121 覚えたい元素記号と化学式 何度も繰り返して覚えよう! 元素記号 は原子番号を示す。 44!これだけ覚えれば,大学入試も完璧です。 1水素 H 2ヘリウム He 3リチウム Li 4ベリリウム Be 5ホウ素 B 6炭素 C 7窒素(チッ素) N 8酸素 O 9フッ素 F



硫酸銅水溶液の化学式は写真の化学式であっていますか い Yahoo 知恵袋



某实验小组对实验室中a B C D四瓶无色溶液进行鉴别 它们分别是硫酸钠 稀硫酸 澄清石灰水 氯化钠四种物质的一种 可供使用的实验用品有 稀盐酸 稀硫酸 碳酸钠 紫色石蕊溶液 硝酸钡溶液 硝酸银溶液 稀硝酸溶液 玻璃棒 试管 胶头滴管 1 请利用提供的实验用品 鉴别出四种物质
酸化数iiの化合物が普通に知られている。化学式cu(oh) 2 。 硫酸銅(ii)cuso 4 水溶液にアンモニアnh 3 を加えると,まず沈殿を生じ,さらにこれが溶けはじめる。 沈殿がちょうど溶解するまでアンモニアを加えた溶液に,アルカリを加えるか,またはこれを硫酸デシケーター中に保存して遊離の酸化第二銅は化学元素の銅の酸化物で、化学式はCuOです。 ここで、1つの銅原子は1つの酸素原子を関連付けます。 酸化銅(II)はそのIUPAC名です。 それは黒い固体として発生し、非常に安定しています。 また、この化合物は自然に鉱物テノライトとして発生します。 また、多くの銅含有化合物の前駆体でもあります。 さらに、この化合物を乾式製錬によって大規模に生産することができます。問2酸化剤としても還元剤としても働く物質がある。その例として,2つの物質を取り上げ,それらがどのように酸化剤とし て働いているか,または,還元剤として働いているかを,化学反応式を書いて示せ。 《過酸化水素 酸化剤:H2O2+2H



新课程高考化学试题分析及对我们的启示丹东教师进修学院 Ppt Download



酸化銅 型構造とは コトバンク
化学変化 化学反応式 酸化銅+炭素→銅+二酸化炭素 2CuO+C→2Cu+CO2 酸化銅+水素→銅+水 CuO+H2→Cu+H2O 二酸化炭素+マグネシウム→炭素+酸化マグネシウム CO2+2Mg→C+2MgO 化学反応式についてまとめてみよう 令和2年4月23日(木) 化学反応式 1 化学反応式とは 化学反応式化学変化のようすを化学式を用いて表したもの。 例銅の酸化 2Cu + O2 → 2CuO 左辺:実験前の物質 右辺:実験後の物質




盐酸 维基百科 自由的百科全书



探究物质的组成或测量物质的含量试题 知识点讲解 才宝



中考化学碳及其化合物三轮实验专练



高中化学难写的化学方程式归纳总结 理科生都需要过一遍 可打印 教育资讯 娱乐新闻网




元素及其化合物和化学基本概念 基本理论的复习建议 Ppt Download



柠檬酸手写化学式库存图片 图片包括有化学 配方 没人 投反对票 技术 酸化 符号 科学




H2o 化学式 Co2 H2o 化学式



初中化学知识点最全总结 溶液



Kuwabara J Esnet Ed Jp



4 2 水的净化第4章自然界的水化学人教版 题库 试题 课件 Ppt 教案 导学案 才宝




H2o 化学式 Co2 H2o 化学式




質問です 酸素はo2と表すのに 酸化銅になるcuoになるのはなぜですか Clearnote




Ppt 第三课时铁及铜的化合物powerpoint Presentation Free Download Id




19高考化学考点必练专题11化工流程大题补差专练下载 Word模板 爱问共享资料



温州市第二十二中学化学命题比赛展示 Ppt Download



化学式とは 一覧表 語呂合わせの覚え方 練習問題付き 中学理科 テラコヤプラス By Ameba




醋酸的化学式怎么书写 星火网校



氢氧化铜化学式 万图壁纸网




化学实验 Ppt Download




H2o 化学式 Co2 H2o 化学式




化学式でag2o 酸化銀 やcuo 酸化銅 など 酸素の化学式はo2なのに Clearnote




中2理科 銅 酸素の化学反応式 練習編1 映像授業のtry It トライイット




File Redox Cuo Chemical Formula Jp Svg Wikimedia Commons



氢氧化铜化学式 万图壁纸网



1



酸化還元反応 電子のやり取り




酸化還元反応 電子のやり取り




9年级化学全年沪教版 61个视频11 2g全 上海空中课堂初三上 下学期 哔哩哔哩




酸化銅の還元 中学生向け




氧化铜 维基百科 自由的百科全书




初中化学知识点




硫酸根化学式 硫酸根是由什么组成和构成的 黑菠萝下载站
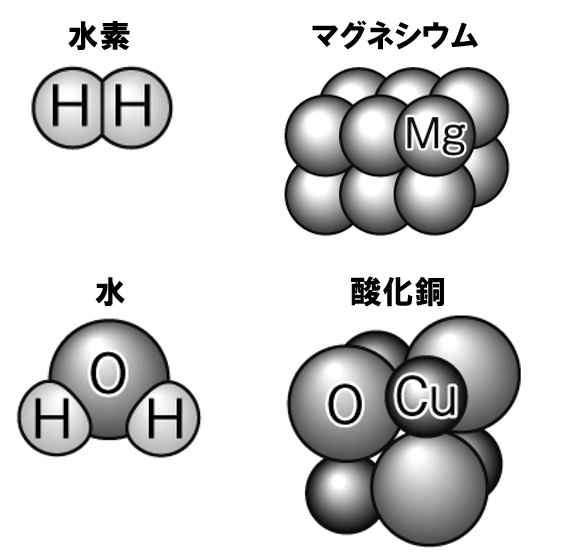



中2理科問題 原子の記号 化学式の暗記用問題 Examee




酸化還元反応 電子のやり取り




H2o 化学式 Co2 H2o 化学式




专题05 元素及其化合物 年高考化学真题与模拟题分类训练 教师版含解析 七七文库www 77wenku Com




Ppt 第三课时铁及铜的化合物powerpoint Presentation Free Download Id




覚えておきたい化学式一覧 Hiromaru Note




酸化銅と炭素の混合物を加熱した時に起こる反応を化学反応式で教えてください Clearnote
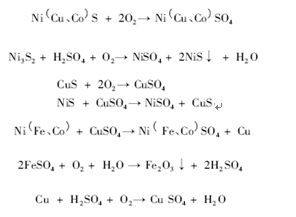



硫酸铜




中2理科 銅 酸素の化学反応式 練習編1 映像授業のtry It トライイット




小王讲高一化学 人教19版必修二第一章第一节硫及其化合物 哔哩哔哩




酸化銅の化学式 2種類の酸化銅を攻略する
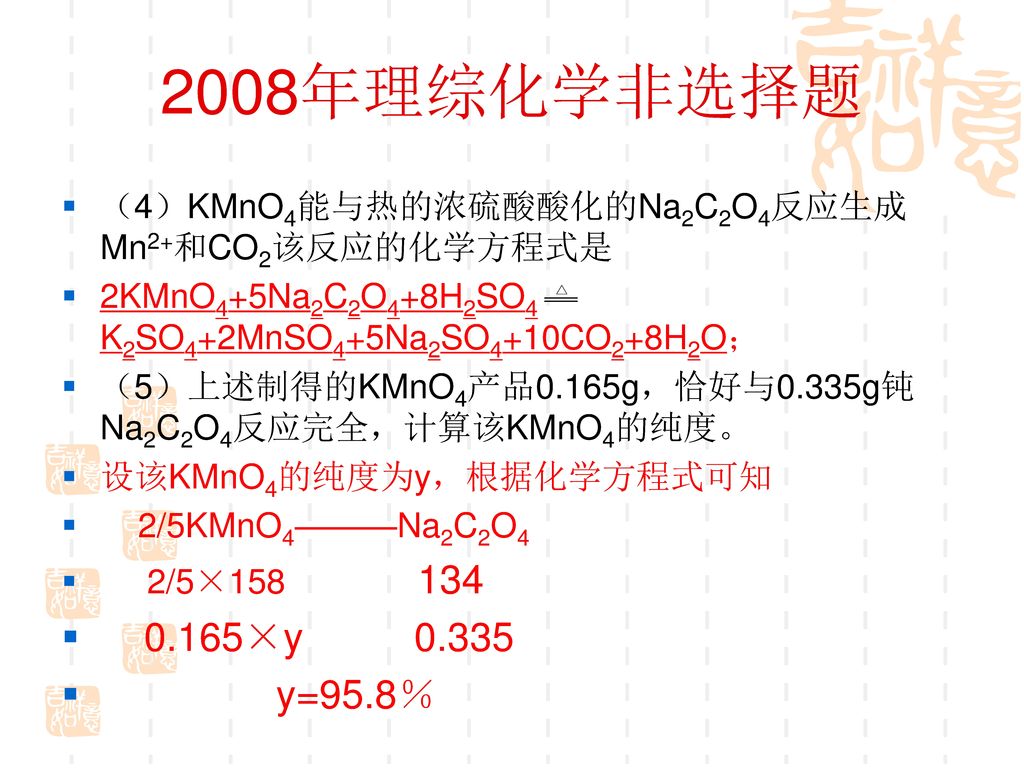



新课程高考化学试题分析及对我们的启示丹东教师进修学院 Ppt Download




H2o 化学式 Co2 H2o 化学式



酸化銅の化学式は Cuoですが Ocuだと間違いなのはなぜですか Yahoo 知恵袋
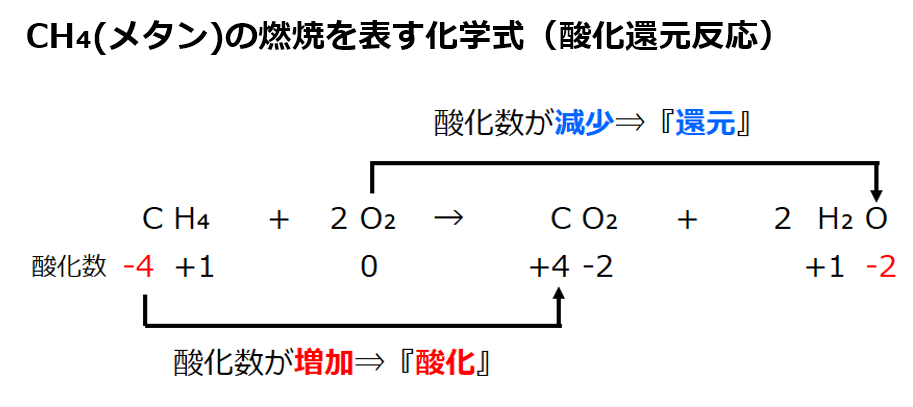



酸化還元反応 電子のやり取り



高中化学 摩尔计算 溶液浓度计算 混合物分离等题解 每日头条




語呂合わせと徹底整理で攻略する高校無機化学 遷移元素と錯イオン篇 永野裕之のblog




語呂合わせと徹底整理で攻略する高校無機化学 遷移元素と錯イオン篇 永野裕之のblog



化学 江苏省盐城市大丰区新丰中学19 学年高一上学期期末考试试题 解析版




H2o 化学式 Co2 H2o 化学式




Cna 化学镀镍浴 Google Patents
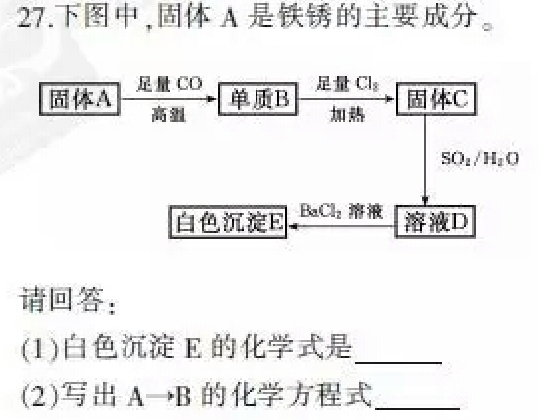



高考元素推断相关 知乎




File Redox Cuo Chemical Formula Jp Svg Wikimedia Commons




耗时2天 我终于把高考化工流程题知识点全部都整理出来了 附带历年真题 知乎



8wnlnqrvllurnm



化合价的概念试题 知识点讲解 才宝



3kknde2qiz804m




H2o 化学式 Co2 H2o 化学式



11中考化学试题汇编 第五单元化学方程式下载 Word模板 爱问共享资料



酸化銅の化学式 2cu O2 2cuo化学反応式にある 2 Yahoo 知恵袋




Ppt 第三课时铁及铜的化合物powerpoint Presentation Free Download Id



19届一轮复习全国通用版第22讲简答题中化学用语的规范书写策略学案



Zrgqa2lueqohxm




銅の錆の種類と成分 銅に出る錆の色と化学式は オイラーマンの学習帳 備忘録 Evangelist Of Metalworkingfluid




Cnb 具有改进的烃耐受性的scr催化转化器 Google Patents



中2化学 銅の酸化 計算問題 Hiromaru Note



1



銅の酸化の説明とよく出る問題 中学理科 化学変化 Hiromaru Note




18 年浙江中考试题专题分类汇编十二 化学基本反应 含答案 七七文库www 77wenku Com



水酸化銅 を加熱すると 酸化銅 Cuoが生じる という反 Yahoo 知恵袋



化学式とは 一覧表 語呂合わせの覚え方 練習問題付き 中学理科 テラコヤプラス By Ameba




中考化學重點複習 實驗探究題類型一反應後物質成分的探究 每日頭條




铬酸根离子化学式 搜狗搜索




酸化銅 I Wikiwand




化学 第三章第二节 醛 Ppt Download



中2理科 酸化と燃焼のポイント Examee
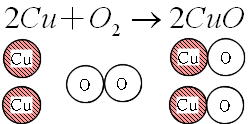



Science 化学変化と質量比 定比例の法則と原子量 分子量 働きアリ



1




酸化還元反応 電子のやり取り




中2理科 化学式の覚え方 三角関係で覚える酸化銅の還元 Youtube




銅の酸化 燃焼 の実験を中学生向けに解説




中2化学 銅の酸化 計算問題 Hiromaru Note




Cnb 一种改性白炭黑的生产方法 Google Patents
コメント
コメントを投稿